Ce site est en construction et sûrement encore bourré de fautes d'orthographe ! Vous pouvez toutefois me laisser vos commentaires sur cette page
L'ATOME
Un peu d'histoire
 |
| Démocrite (-460 - -370) |
Il y a un peu plus de deux millénaires, vers 400 av. J.-C., un philosophe Grec nommé Démocrite tenta de comprendre la nature de la matière. Il essaya par l'esprit de manipuler l'immense loupe que je vous proposais en guise d'introduction.
Dans son esprit germa alors l'idée que la matière était constitué d'une multitude de petits grains élémentaires et insécables : les atomes. Il devint du même coup l'un des premiers défenseurs de la théorie atomiste aujourd'hui acceptée de l'ensemble de la communauté scientifique.

La matière selon Démocrite : un ensemble d'atomes insécables de formes diverses séparés par du vide.
Nous savons aujourd'hui que les atomes sont la base de la matière qui nous entoure. Le fer est ainsi composé d'un ensemble d'atomes de fer, le cuivre d'un ensemble d'atomes de cuivre et ainsi de suite. Pendant très longtemps, on cru que l'atome était le plus petit composant de la matière, qu'il n'y avait rien en dessous.
 |
| J.J. Thomson (1856 - 1940) |
Cette idée de l'atome comme ultime étape d'un voyage vers l'infiniment petit vola en éclat en 1897, quand un certain Joseph John Thomson prouva la présence dans l'atome d'un corpuscule à la masse très inférieure à celle de n'importe quel atome : l'électron. Cette découverte à ouvert la voie à une des plus formidable quête du XX° siècle. Une aventure dont nous n'avons encore aujourd'hui aucune idée de la fin, et qui nous a déjà apporté nombre de réponses insoupçonnées sur le fonctionnement physique de notre monde.
Expérience de J.J. Thomson (1897)
CLIQUEZL'expérience de J.J. Thomson portait sur les rayons cathodiques dont la nature était inconnue à l'époque.
Le mot cathodique vous est sans doute familier, et pour cause, le rayon cathodique étudié est le même que celui venant inscrire des images sur l'écran de votre ordinateur ou de votre télévision (sous réserve que vous n'ayez pas encore opté pour un écran plat).
Après avoir prouvé que les rayons cathodiques étaient chargés négativement, J.J. Thomson chercha à analyser plus finement les propriétés de ce rayon cathodique.
En étudiant les trajectoires de ces rayons déviés par des champs magnétiques il arriva à la conclusion qu'ils étaient composés de particules dont les caractéristiques ne correspondaient à aucun atome.
Il venait de découvrir la première particule : l'éléctron.Il ajoute même que l'électron fait parti de intégrante de la structure des atomes, ces derniers deviennent donc pour la première fois divisibles.
Le modèle de Bohr
L'ATOME Un peu d'histoire
 Le modèle de Bohr
Le modèle de Bohr - LA CONSTANTE DE PLANCK -
- LA CONSTANTE DE PLANCK -- LA DÉCOUVERTE DE RUTHERFORD -
- LE MODÈLE -
Plus de détails ! - LE PROTON -
- LE NEUTRON -
Ions et isotopes - LES IONS -
- LES ISOTOPES -
- LES RADIOACTIVITÉS -
Résumé
 |
| Niels Bohr (1885 - 1962) |
Nous savons donc en cette année 1897 que l'atome n'est pas ce corpuscule indivisible auquel nous pouvions encore croire. Mais alors quelle est sa véritable nature ? De quoi est-il composé ? Comment se structure-t-il ? C'est en réponse à ces questions que des scientifiques vont proposer des "modèles" de l'atome, tentant de coller au mieux à la réalité.
Parmi tous ces modèles, celui encore considéré à l'heure actuelle comme le plus proche de la réalité est celui de Schrödinger. Toutefois, même s'il est inexact, le modèle de Bohr de part sa relative simplicité offre une meilleure approche du fonctionnement de l'atome.
Avant d'aborder le modèle proprement dit, il est important
d'avoir en tête deux découvertes majeures qui inflenceront grandement Niels Bohr (07 octobre 1885 - 18 novembre 1862)Physicien danois, Prix Nobel de physique en 1922
(07 octobre 1885 - 18 novembre 1862)Physicien danois, Prix Nobel de physique en 1922
Spécialiste de la physique atomique
et nucléaire, il est notamment connu pour avoir publier un modèle cohérent de la structure de l'atome et pour être à l'origine du
principe de complémentarité.
dans la conception de son modèle : celles de Max Planck (23 avril 1858 - 4 octobre 1947) Physicien allemand, Prix Nobel de physique en 1918 et lauréat du prix Goethe en 1945.
(23 avril 1858 - 4 octobre 1947) Physicien allemand, Prix Nobel de physique en 1918 et lauréat du prix Goethe en 1945.
Il est
à l'origine de la fameuse constante de Planck et de la révolution quantique. et d'Ernest Rutherford faites respectivement en 1900
et en 1909.
- LA CONSTANTE DE PLANCK -
 |
| Max Planck (1858 - 1947) |
Si nous savions déjà en 1900 que les atomes pouvaient absorber et rayonner de l'énergie sous forme d'ondes éléctromagnétiques, nous estimions également que n'importe quelle quantité d'énergie pouvait être émise ou absorbée.
Seulement à cette époque la théorie était dans une impasse, elle se heurtait à certaines expérience qui la contredisait de manière forte (voir catastrophe ultraviolette). La physique se mit alors en quête d'idées neuves qui lui permettrait de dépasser les impasses auxquelles menaient ses théories.
C'est ce que fit Max Planck (23 avril 1858 - 4 octobre 1947) Physicien allemand, Prix Nobel de physique en 1918 et lauréat du prix Goethe en 1945.
(23 avril 1858 - 4 octobre 1947) Physicien allemand, Prix Nobel de physique en 1918 et lauréat du prix Goethe en 1945.
Il est
à l'origine de la fameuse constante de Planck et de la révolution quantique. en montrant que seuls
des paquets d'énergie d'une valeur bien précise pouvaient être rayonnés
ou absorbés par l'atome, initiant ainsi la révolution
quantique.
La révolution quantique, c'est un peu comme si vous vous aperceviez tout d'un coup que votre voiture avance de 10 mètres en 10 mètres alors que vous croiiez jusqu'ici qu'elle avancait de manière "fluide". Le choc de cette annonce sur votre conception du monde est comparable à celui qu'eu sur les physiciens de l'époque la découverte de Plancke.
La constante de Planck (1900)
CLIQUEZMax Planck joua un rôle primordial dans le développement de la physique de l'infiniment petit, en apportant une réponse valide au problème de la catastrophe ultraviolette. Je ne rentrerais pas ici dans les détails de cette catastrophe ultraviolette, mais vous invite à suivre ce lien pour en savoir plus.
On sait depuis longtemps que les atomes sont capables d'absorber ou ou de délivrer (rayonner) de l'énergie. Jusqu'en 1900 on pensait que cette quantité d'énergie pouvait prendre n'importe quelle valeur, devant les résultats absurdes qu'engendrait une telle hypothèse Max Planck postulat que l'énergie ne pouvait en réalité être rayonnée ou absorbée que par paquets, ce postulat initia ce que l'on appelle aujourd'hui la révolution quantique.
Un atome émet ou absorbe de l'énergie sous forme d'onde
éléctromagnétiques à des fréquences qui lui sont propres, selon Planck
il ne peut émettre ou absorber de l'énergie que par paquets
proportionnels à ces fréquences. La valeur de ce paquet des données par
la formule : 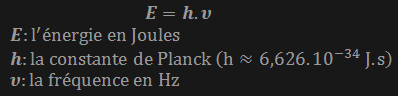
Ces paquets peuvent également être appelés quantas d'énergie, cet intitulé donna son nom à la physique quantique.
- LA DÉCOUVERTE DE RUTHERFORD -
 |
| E.Rutherford (1871 - 1937) |
Ernest Rutherford, quant à lui, montra en 1909 que les atomes contenaient
un noyau dont la taille est très inférieure à celle
de l'atome.
Expérience de E. Rutherford (1909)
CLIQUEZVoici de manière simplifié comment Ernest Rutherford et ses assistants découvrirent que l’atome était composé d’un noyau entouré d’un grand volume de vide.
Ils eurent l’idée de projeter un rayon de particules alpha (noyaux d’hélium, chargés positivement par définition) vers une feuille d’or très fine (6000 Å).
Derrière cette feuille d'or un capteur permet de localiser le point d'impact des particules.

Pour chaque particule traversant la feuille d’or il y a deux possibilités :
- Soit elle ne rencontre que du vide, auquel cas sa trajectoire n'est pas déviée ;
- soit elle passe à proximité d’une autre charge positive, auquel cas sa trajectoire est déviée (deux charges positives se repoussant mutuellement)
Après quelques minutes on arrête l'expérience. Sur le capteur on observe qu'à peu près 1 particule sur 10 000 est dévié de sa trajectoire initiale. On en déduit indirectement que la matière :
- est principalement constituée de vide, c'est pour cela que la majorité des particules ne sont pas déviés ;
- contient quelques îlots de charge positive expliquant la déviation de quelques particules.
De cette expérience on tira un modèle "planétaire" de l'atome, c'est à dire un noyau chargé positivement au centre, et un ensemble d'électrons chargés négativement gravitant autour, un peu comme la lune gravite autour de la Terre, ou la Terre autour du Soleil.
- LE MODÈLE -
De ces deux découvertes majeures restait à tirer un modèle de l'atome cohérent.
Niels Bohr (07 octobre 1885 - 18 novembre 1862)Physicien danois, Prix Nobel de physique en 1922
(07 octobre 1885 - 18 novembre 1862)Physicien danois, Prix Nobel de physique en 1922
Spécialiste de la physique atomique
et nucléaire, il est notamment connu pour avoir publier un modèle cohérent de la structure de l'atome et pour être à l'origine du
principe de complémentarité. s'attela à cette tâche, et en 1913 il réussit à fournir
un modèle de l'atome rendant compte de ces phénomènes.
Le défi de Niels Bohr (07 octobre 1885 - 18 novembre 1862)Physicien danois, Prix Nobel de physique en 1922
(07 octobre 1885 - 18 novembre 1862)Physicien danois, Prix Nobel de physique en 1922
Spécialiste de la physique atomique
et nucléaire, il est notamment connu pour avoir publier un modèle cohérent de la structure de l'atome et pour être à l'origine du
principe de complémentarité. fut donc de
proposer un modèle de l'atome constitué d'un noyau et
capable d'absorber ou de rayonner de l'énergie par paquet.
- Pour le noyau, rien de bien compliqué, il le placa au centre de l'atome.
- Concernant la seconde contrainte il imagina autour du noyau un ensemble d'électrons gravitant chacun sur une orbite bien définie. Lorsque l'atome recoit un paquet d'énergie dont la valeur est donnée par la formule de Planck, un électron "saute" sur une orbite plus éloignée du noyau, l'énergie de l'atome est ainsi augmentée. A l'inverse, lorsque l'atome restitue un paquet d'énergie, un électron "saute" sur une orbite plus proche du noyau, réduisant ainsi l'énergie de l'atome.
Ces quantas d'énergie sont absorbés ou émis sous forme d'ondes éléctromagnétiques.
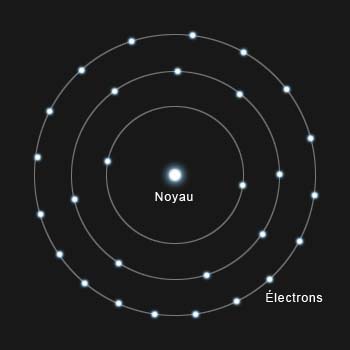
Le modèle de Bohr : des électrons gravitant autour d'un noyau sur des orbites définies
Ce modèle, aussi séduisant soit-il, n'est malheureusement pas exact, il nous permet toutefois de comprendre les grandes lignes du fonctionnement et de la structure de l'atome.
Il a également l'immense avantage d'être intelligible, c'est à dire que l'on est capable sans trop d'effort de se le représenter, ce qui n'est pas le cas du modèle suivant : le modèle de Schrödinger, encore considéré aujourd'hui comme étant le plus proche de la réalité.
Plus de détails !
L'ATOME Un peu d'histoire Le modèle de Bohr - LA CONSTANTE DE PLANCK -
- LA DÉCOUVERTE DE RUTHERFORD -
- LE MODÈLE -
 Plus de détails !
Plus de détails ! - LE PROTON -
- LE PROTON -- LE NEUTRON -
Ions et isotopes - LES IONS -
- LES ISOTOPES -
- LES RADIOACTIVITÉS -
Résumé
Un atome est donc constitué d'un noyau en son centre et d'un nuage d'électrons. Mais il est possible d'aller encore plus loin et de décrire la composition du noyau lui même.
Ceux sont deux découvertes majeures qui nous firent avancer dans l'exploration du noyau :
- En 1919 Ernest Rutherford montra que le noyau de l'atome n'était pas "monobloc" mais contenait notamment un ou plusieurs protons.
- Un peu plus tard, en 1932, James Chadwick découvrit le neutron , le second composant du noyau atomique.
Les protons et les neutrons qui composent le noyau d'un atome sont également appelés les nucléons.
- LE PROTON -
Le proton a une charge éléctrique positive d'une valeur exactement inverse à celle de l'électron (±1,602.10-19 Coulombs). Cette charge à deux conséquences :
- les protons et les électrons étant de charges opposées ils s'attirent mutuellement (comme deux aimants), ce qui explique que les électrons dans l'atome restent à proximité du noyau composé de protons (il n'y a pas d'autres éléments chargés présents dans le noyau);
- si un atome contient autant de protons que d'électrons il a alors une charge électrique nulle (protons et électrons sont les seules particules chargées composant l'atome), on parle alors d'atome neutre.
Le nombre de protons dans le noyau permet de classifier les atomes neutres dans un tableau périodique, des atomes présents dans ce tableau sont ensuite déduit tous les autres atomes (ions et isotopes).
Ce nombre de protons est aussi appelé nombre atomique et est noté Z.
- LE NEUTRON -
Contrairement aux autres constituants du noyau, le neutron a une charge neutre (comme son nom l'indique) et une masse très proche de celle du proton (l'électron quant à lui à une masse de l'ordre de 1000 fois inférieure).
Le tableau périodique
CLIQUEZLe tableau périodique nous permet d'avoir une classification claire de l'ensemble des atomes.
Dans ce tableau les atomes sont classés par numéro atomique de gauche à droite et de haut en bas. Le tableau est dit périodique car les élements d'une même colone ont des comportements chimiques similaires, ceci en raison du fait qu'ils possèdent le même nombre d'électrons sur leur couche de valence (la couche la plus éloignée du noyau intervenant dans les réactions chimiques).
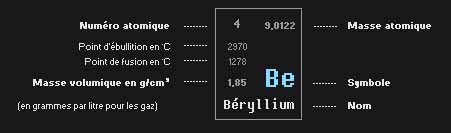
Explication du tableau périodique
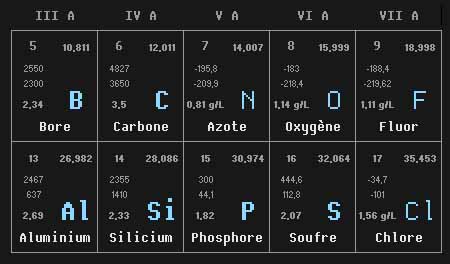
Extrait du tableau périodique.
Je ne présente ici qu'un extrait du tableau périodique, et vous invite à visiter la magnifique version publiée par la Cité des Sciences.
Ions et isotopes
L'ATOME Un peu d'histoire Le modèle de Bohr - LA CONSTANTE DE PLANCK -
- LA DÉCOUVERTE DE RUTHERFORD -
- LE MODÈLE -
Plus de détails ! - LE PROTON -
- LE NEUTRON -
 Ions et isotopes
Ions et isotopes - LES IONS -
- LES IONS -- LES ISOTOPES -
- LES RADIOACTIVITÉS -
Résumé
- LES IONS -
Les ions sont des atomes dont le nombre d'électrons diffère du nombre de protons, un ion est par conséquent chargé électriquement :
- s'il possède moins d'électrons (charge négative) que de protons (charge positive) il est alors globalement chargé positivement (c'est un cation);
- à l'inverse s'il possède plus d'électrons que de protons il est chargé négativement (c'est un anion).
On note les ions relativement à l'atome neutre ayant le même nombre de protons, ne se différenciant donc que par son nombre d'électrons.
Par exemple l'atome de cuivre (noté Cu) a un noyau contenant 29 protons (Z=29), sa version neutre possède donc 29 électrons. Une de ses versions ionisée : Cu2+ ne possédera que 27 électrons et sera donc chargé positivement (le 2+ signifie qu'il lui manque deux électrons relativement à sa version neutre). A l'inverse l'ion Cu2- possédera 31 électrons.
- LES ISOTOPES -
Deux atomes sont dits isotopes s'ils possèdent les mêmes nombres d'électrons et de protons mais un nombre différents de neutrons. On nomme des isotopes par le nom de l'atome suivi du nombre de nucléons qu'il possède.
Par exemple le carbone 12 possède douze nucléons et le carbone 14 quatorze, ils possèdent tous les deux le même nombre de protons (6) mais un nombre différent de neutrons (respectivement 6 et 8).
Deux isotopes ont donc une charge identique mais une masse différente.
Il existe deux grandes familles d'isotopes :
- les isotopes stables qui ne varient pas au cours du temps;
- les isotopes radioactifs qui se transforment au cours du temps : certains isotopes ne sont pas stables et finissent par se transformer. L'exemple le plus connu d'isotope radioactif est le carbone 14 qui se transforme en azote. Le carbone 14 devient azote quand un de ses neutrons se transforme en proton, cette transformation s'accompagne d'un rayonnement radioactif (rayonnement β).
La datation au carbone 14
CLIQUEZLes ondes lumineuses (qui sont en réalité des ondes électromagnétiques) sont alors notamment caractérisées par leur vitesse qui est constante dans le vide (approximativement 3.108 m.s-1, soit un peu plus d'un milliard de kilomètres par heure), ainsi que par leurs fréquences qui conditionnent leurs couleurs, ainsi plus une onde lumineuse a une fréquence élevée plus sa couleur tend vers le bleu, à l'inverse plus sa fréquence est faible plus elle tend vers le rouge.
La longueur d'onde est directement
liée à la fréquence suivant la formule : 
- LES RADIOACTIVITÉS -
On distingue dans notre environnement deux types de radioactivité :
- la radioactivité α;
- la radioactivité β.
La radioactivté α correspond à la perte pour un noyau atomique de deux protons et de deux neutrons, ceux-ci sont éjectés sous forme de particules α (noyau d'hélium composé des deux neutrons et des deux protons).
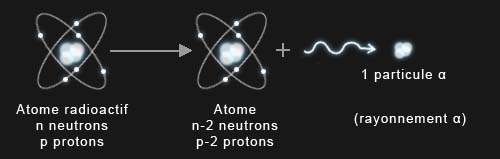
La désintégration alpha (radioactivité α).
La radioactivité β correspond à la désintégration d'un neutron en un proton et deux autres particules :
- dans le cas de la radioactivité β- les particules émises sont un électron et un antineutrino;
- dans le cas de la radioactivité β+ les particules émises sont un positon (anti-électron) et un neutrino;
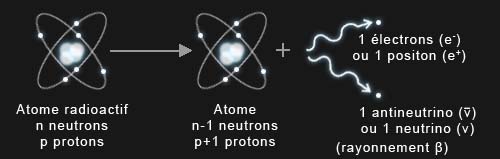
La désintégration bêta (radioactivité β).
Résumé
Nous voilà donc (déjà) arrivé à la fin de la première étape de notre voyage, celle où nous avons exploré la nature de l'atome.
Nous savons donc maintenant que les atomes ne sont pas les grains insécables imaginés par Démocrite, mais qu'ils ont une structure
beaucoup plus élaborée; constituée d'un noyau de charge positive et d'un nuage d'électrons autour. Nous avons vu que le noyau était
lui même composé de neutrons et de protons.
Même si nous l'avons déjà rapidement abordé, il est temps de nous plonger un peu plus dans notre sujet principale : les particules.